Болезнь Альцгеймера — наиболее распространённая форма деменции в мире, связанная с постепенной гибелью нервных клеток мозга и утратой памяти, речи и элементарных навыков самообслуживания. С момента первого официального описания более века назад, эта патология считалась неизлечимой, а прогноз — неутешительным. Однако новые научные достижения позволяют по-новому взглянуть на перспективы будущего миллионов людей, столкнувшихся с этим диагнозом. По оценкам специалистов, к 2030 году с деменцией будет жить до 78 миллионов человек, а к 2050-му — число пациентов превысит 150 миллионов.
Традиционные подходы и их пределы
Долгое время медицинское сообщество располагало только средствами, способными замедлить проявления заболевания, но не остановить его неумолимое развитие. Большинство существующих лекарств рынка дают краткосрочный эффект на ранних стадиях, поддерживая мыслительные способности, но не могут восстановить уже разрушенные связи между нейронами. Даже последние попытки применения противоопухолевых препаратов открыли лишь частичный временный эффект — полного выздоровления добиться не удавалось.
Прорыв под руководством Эндрю Пайпера
Уникальные результаты получили исследователи из Университета Кейс-Вестерн-Резерв под руководством Эндрю Пайпера. Команда учёных сосредоточила свои усилия на молекуле P7C3-A20, обладающей ярко выраженным нейропротекторным действием. Это соединение активно восстанавливает баланс никотинамидадениндинуклеотида (NAD⁺), универсального компонента, необходимого для энергетического обмена и поддержания здоровья клеток мозга. Именно дефицит NAD⁺ признан причиной снижения «устойчивости» нервной системы к прогрессированию болезни Альцгеймера.
Экспериментальные успехи: возвращение памяти и когнитивных функций
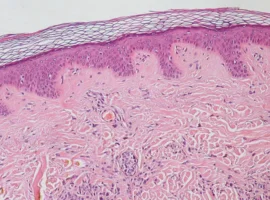
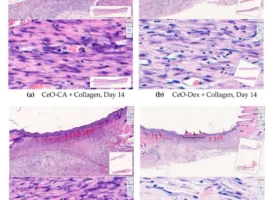
Учёные протестировали P7C3-A20 на двух различных генетических моделях Альцгеймера у лабораторных мышей. Одна из них имитировала накопление бета-амилоида в тканях мозга, вызывающего гибель нервных клеток, вторая — формирование внутри нейронов агрегатов патологического тау-белка. После курса терапии исследуемым препаратом мыши показали поразительное восстановление: исчезли признаки воспаления, окислительный стресс и повреждения ДНК. Повторные тесты подтвердили возвращение памяти и способности к обучению.
Отдельное внимание получили такие показатели, как нормализация уровня тау-белка p-tau217 — ключевого маркера заболевания, и восстановление синаптической активности гиппокампа, отвечающего за процессы запоминания. Животные вновь демонстрировали нормальное поведение в познавательных тестах, что раньше считалось невозможным при столь выраженных неврологических нарушениях.
NAD⁺ — ключ к пусть к надежде на будущее
Сравнив результаты экспериментов с анализом структур человеческого мозга, исследовательская группа сделала крайне обнадёживающий вывод: тяжесть болезни Альцгеймера у людей, как и у мышей, связана со снижением уровня NAD⁺. Особенно интересно, что у пациентов с аналогичными мозговыми изменениями, но без потери интеллекта (их относят к NDAN-группе), наблюдается стабильность NAD⁺, что говорит о наличии природного защитного механизма. Эти данные подчеркивают высокую перспективность фармакологического усиления мозговой резистентности.
Помимо этого, молекулярное исследование позволило выделить 46 белков, вовлечённых в митохондриальные процессы, обмен липидов и воспалительные реакции. Именно их норма после терапии P7C3-A20 была подтверждена как у мышей, так и при сравнении с тканями людей. Они могут стать мишенями новых методик для предотвращения и лечения заболевания на разных этапах его развития.
Изменение парадигмы и горизонты фармакологической терапии
Полученные учёными данные резко расширяют традиционное представление о болезни Альцгеймера. Оказывается, патология связана не только с накоплением токсичных белков, но и с нарушением способности мозга восстанавливать свои структуры и функции. Исследование непосредственно свидетельствует: поражённый мозг не утрачивает полностью потенциал к «ремонту». Это необычайно вдохновляет, ведь теперь открываются пути для разработки совершенно новых средств лечения, способных помочь пациентам даже на поздних стадиях деменции.
Конечно, в настоящее время все испытания ограничены моделями на животных, и безопасное применение инновационного соединения у людей требует многоступенчатых доклинических исследований. Однако оптимистические перспективы очевидны: если эффективность и безопасность P7C3-A20 подтвердится, это может коренным образом изменить судьбу миллионов пациентов.
Взгляд в будущее: реализация новых стратегий
Работа коллектива под руководством Эндрю Пайпера вдохновляет научное и медицинское сообщество по миру. Появилась реальная надежда, что болезнь Альцгеймера вскоре перестанет быть окончательным приговором, а восстановление функций мозга станет возможным для многих. Открытие универсала Кейс-Вестерн-Резерв не только расширяет понимание основ нейродегенерации, но и задаёт новый ориентир для всего направления нейронаук. Позитивные перемены ближе, чем может показаться, а уникальные подходы позволят не только замедлять, но и побеждать тяжёлые заболевания мозга!
Источник: naked-science.ru